|
味を感じる仕組み
京都女子大学 家政学部
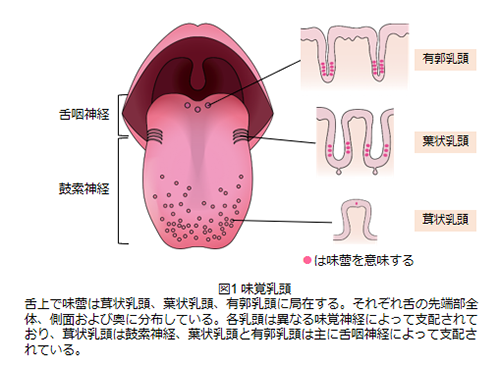
食物栄養学科 准教授 成川 真隆 はじめに食物の味は5つの基本味-甘味、うま味、苦味、酸味、塩味-に分類される。基本味は味細胞で受容され、互いが明確に区別できる味と定義される。辛味、渋味は食物の味を形成する上で重要な味質であるが、辛味は痛覚を介して、渋味は物理的な収れん感覚であると考えられるため、基本味ではなく補助味に分類される。本稿では基本味の受容に焦点を当て解説する。 味は栄養素の存在を示すシグナル食物の味はその食物に含まれる栄養素の存在を示すシグナルであると考えられている。甘味は糖類、うま味はアミノ酸、塩味は塩類、酸味は有機酸や無機酸、苦味はアルカロイドによって主に引き起こされる。これはエネルギー源となる糖類が甘味、タンパク質の分解産物であるアミノ酸がうま味、ミネラル分が塩味、未熟な果実や腐敗物が酸味、毒物が苦味を引き起こすと言い換えることができる。生物は甘味やうま味、塩味を好むが、これはこれらが糖、タンパク質、ミネラルといった生命を維持する上で必要なものから引き起こされるシグナルであるからだといえる。一方、酸味や苦味を基本的に好まないのは、それらが忌避されるべきものに由来するシグナルであるからである。つまり、食物の味はその食物を摂取すべきかすべきでないかを判断する材料となる。 味を感じる細胞味は食物に含まれる味物質が味蕾によって検出されることで生じる。味蕾は数十個の味細胞から形成され、味物質は味細胞に存在する味覚受容体によって検出される。検出された味情報は、味覚神経を介して、脳に情報が伝達される。 口腔内で味蕾はおよそ数千個存在し、約2/3が舌に、残りが軟口蓋、咽頭などに分布する。舌上では有郭乳頭、葉状乳頭、茸状乳頭に局在し、それぞれ舌の奥、側面および先端部全体に分布している(図1)。
各乳頭は異なる味覚神経、茸状乳頭は鼓索神経、葉状乳頭と有郭乳頭は主に舌咽神経、によって支配されている。 味を感じるセンサー近年の研究の進展により、味を感じるセンサーである味覚受容体が同定された(図2)。
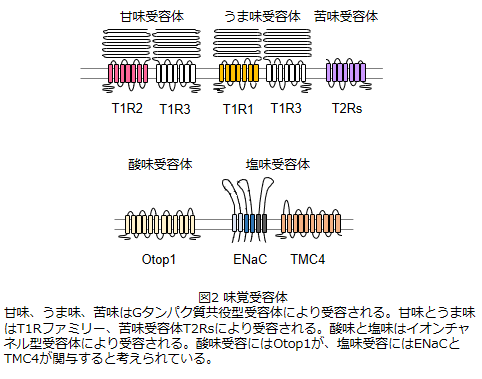
甘い、苦いなどの味質はどの味覚受容体によって検出されるかで決まる。したがって、味覚受容体を明らかにすることは味の受容を理解する上で極めて重要な情報となる。 甘味、うま味、苦味はGタンパク質共役型受容体により受容される。甘味、うま味受容体はT1Rファミリーに属する。T1RはT1R1、T1R2、T1R3の3種類の分子から成る。このうち、T1R2とT1R3がヘテロマーを形成することで甘味受容体として機能する一方1)、T1R1とT1R3がヘテロマーを形成することでうま味受容体として機能する2)。甘味受容体T1R2/T1R3は、糖やアミノ酸、タンパク質など天然に存在する甘味料だけではなく、スクラロースなどの合成甘味料も認識する。うま味の受容にはT1R1/T1R3の他に代謝型グルタミン酸受容体の関与も示唆されている3)。しかし、グルタミン酸受容体はグルタミン酸に対して応答を示す一方で、イノシン酸のような核酸系うま味物質には応答しない。また、相乗的なうま味応答も示さない。一方で、T1R1/T1R3はグルタミン酸だけではなく、核酸系うま味物質に対しても応答を示す。さらに相乗的な応答が認められることから、T1R1/T1R3が主要なうま味受容体として機能すると考えられている。 苦味はT2Rファミリーにより受容される4)。味覚受容体の中ではT2Rファミリーが最も多様であり、機能的なT2Rはヒトで25種類存在する。苦味物質は極めて多種多様な構造を有するが、それぞれのT2Rが苦味物質に対して異なる親和性を有することで、膨大な数の苦味物質の検出をすると考えられる。 一方、酸味と塩味はイオンチャネル型受容体により受容される。酸味受容体としては、最近Otop1が同定された。Otop1はプロトンチャネルとして機能し5)、Otop1をノックアウトすることでマウスの酸味応答が特異的に消失したことから6)、Otop1が主要な酸味受容体として機能すると考えられている。塩味の受容については下記で詳しく述べるが、ENaCやTMC4などの関与が示唆されている7, 8)。 味の相互作用複数の味物質が共存することで、味の感じ方に変化が生じることを味の相互作用という。相乗効果(2種類以上の味物質を混合したときに、それぞれが単独の場合よりも味が強くなる)、対比効果(一方の味を顕著にする)、相殺効果(互いの味を打ち消し合う)などが味の相互作用として知られている。これら味の相互作用がどのようにして生じるのか、その分子メカニズムについては不明な点が多いが、多くは味覚受容体レベルで説明できると考えられる。例えば、昆布(グルタミン酸)と鰹節出汁(イノシン酸)を合わせることでうま味が飛躍的に強くなるうま味の相乗効果が知られているが、これはうま味受容体T1R1/T1R3に対するうま味物質の結合様式から次のように説明される9)。 うま味物質の結合領域はT1R1のN末細胞外領域に存在し、グルタミン酸とイノシン酸はそれぞれ別々のT1R1領域に結合する。グルタミン酸は結合領域の奥に結合する一方で、イノシン酸はグルタミン酸の手前に結合する。イノシン酸の共存下では、T1R1の構造が微妙に変化し、グルタミン酸がより強固にT1R1と結合することでシグナルが増強され、結果としてうま味が強くなる、すなわち相乗効果が生じる。 新規な塩味受容分子の同定前述したように、これまでに多くの味覚受容体が同定され、味受容の全容が明らかになりつつある。しかし、塩味受容に関しては不明な点が残されている。食塩の過剰摂取が広く社会問題となっていることから、筆者らのグループではこれまで塩味受容に関わる分子の同定を試みてきた。その結果、電位依存性クロライドチャネルTransmembrane channel like 4(TMC4)が塩味受容に関与することを最近見出した8)。 塩味の受容は、利尿剤アミロライドに対する感受性の違いから、アミロライド感受性(Amiloride Sensitive: AS)とアミロライド非感受性(Amiloride Insensitive: AI)に分けられる。アミロライドは上皮性ナトリウムチャネルENaCの阻害剤であることから、ASはENaCによって媒介されると考えられている。実際、ENaCを欠損したマウスではAS塩応答が消失する7)。一方、AIに関わる分子は長年不明であった。興味深いことに、マウスと異なり、ヒトの塩味感覚はアミロライドによってほとんど抑制されない。つまり、ヒトの塩味感覚ではASよりもAIの占める割合が高い。したがって、AIに関わる分子の同定はヒトの塩味受容を明らかにする上で重要になると考えられる。そこで、筆者らは特にAIに着目し検討を進めた。 まず候補分子を絞り込むために、味蕾に発現する遺伝子の解析を実施した。前述したように味蕾は舌上で茸状乳頭と葉状、有郭乳頭に局在し、それぞれ鼓索神経と舌咽神経によって支配されている。過去の検討から、ASには茸状乳頭-鼓索神経が関与する一方、AIには有郭乳頭-舌咽神経が主に関与することが知られている。そこで、有郭乳頭を対象として味蕾特異的に発現する遺伝子の網羅的な解析を実施した。得られた結果を発現量と推定される機能からスクリーニングし、TMCファミリーを抽出した。哺乳類でTMCファミリーはTMC1~8の8種類が知られている。これらの味蕾における発現を解析したところ、Tmc4 mRNAの味蕾特異的な発現が認められ、特に有郭乳頭で強いシグナルが観察された。 Tmc4 mRNAの味蕾特異的な発現が観察されたことから、次いでTmc4欠損マウスを作製し、味受容におけるTMC4の役割について検討した。舌で検出した味シグナルを中枢に伝える味覚神経の活動を記録したところ、基本味刺激に対する鼓索神経応答において野生型と欠損マウス間で有意な差は認められなかった。しかし一方で、欠損マウスの舌咽神経では塩味刺激に対する応答が野生型に比べて有意に低下しており、TMC4の欠損が塩味応答の低下を導くことがわかった。このようにTmc4 mRNAが有郭乳頭で強く発現し、Tmc4欠損マウスの舌咽神経で塩味応答が減少したことから、TMC4はAI塩味受容で機能する分子であると考えられた。 同時に培養細胞を用いてTMC4の電気生理学的特性を調べた。TMC4が媒介する電流は電位依存的に変化し、クロライドチャネル阻害剤によりその応答が顕著に抑制された。一方、細胞内外液に含まれる陽イオン、正電荷を有する高分子NMDGやアミロライドによる影響は受けなかった。これらのことから、TMC4がアミライド非感受性の電位依存性クロライドチャネルであることがわかった。 以上の結果は、AI塩味応答においてクロライドイオンが鍵となることを意味する。塩味の発生にはナトリウムイオンが重要な働きをすることが知られているが、ヒトが純粋な塩味を感じるためには、塩化ナトリウムのようにNa+とCl-の両者の存在が必須である。塩化カリウムや酢酸ナトリウムのようにいずれかを他のイオンに置き換えた分子では塩化ナトリウムと同じような味を呈さない。これまでの塩味研究では、ナトリウムイオンに着目した検討が主流であり、クロライドイオンの役割やその受容分子についての報告は乏しかった。本成果は塩味受容におけるクロライドイオンの重要性を改めて示す結果であるといえる。 おわりに食品やその成分の呈味特性を評価する方法として、官能評価や理化学分析が広く行われている。両者とも優れた方法であるものの、官能評価は客観性や再現性という点が、理化学分析は評価基準が物理化学的な特性であることから、生体が感じている感覚ではない点が短所となる。一方、味覚受容体アッセイは測定値が被検物質の物理化学的性質に影響される場合もあるが、生体がもつ検出系を模倣しているという点で他の測定法にはないアドバンテージを有する。特に増強剤や抑制剤のような修飾物質をスクリーニングする際に有効な手段となる。 筆者らはヒトTMC4(hTMC4)を対象とした詳細な応答解析から、hTMC4応答の特徴がヒト官能上の特徴と一致することを見出している10, 11)。例えば、ヒトは体温付近で塩味を強く感じる一方で、pHの低下により塩味は抑制されることが知られる。つまり、塩味は温度やpHに影響を受ける。この官能上の特徴と同様に、hTMC4の活性は体温付近で強く活性化した一方で、pHの低下により抑制された。また、非ステロイド性抗炎症薬がヒトの塩味感受性に影響することが知られていることから、非ステロイド性抗炎症薬のENaCとhTMC4の塩応答に与える影響を調べた。その結果、非ステロイド性抗炎症薬はENaCの食塩応答には影響しなかったが、hTMC4の食塩応答を大きく抑制した。これらの結果はヒトの塩味受容においてもhTMC4が重要な役割を果たす可能性を強く示す。 日本人の食生活上の問題として、食塩の過剰摂取があげられる。食塩の過剰摂取は高血圧や循環器疾患など様々な疾病との係わりがあることから、減塩を如何に促進させるかが大きな課題となっている。その解決策の一つに、塩味エンハンサーがあげられる。hTMC4の食塩応答はヒト塩味感覚と非常に近い特徴を有することから、今後hTMC4を塩味エンハンサー探索に活用することで、効果的な物質の開発が可能になると期待される。 謝 辞本稿で紹介した塩味受容に関する取り組みは、主に東京大学大学院農学生命科学研究科味覚サイエンス研究室 特任教授 朝倉富子先生、同 共同研究員 笠原洋一氏との共同研究の成果である(研究室HP:http://webpark1660.sakura.ne.jp)。両先生をはじめ、研究に携わってくださった共同研究者の方々に深く感謝申し上げます。 文 献
略歴成川 真隆 京都女子大学 家政学部 准教授
静岡県立大学大学院生活健康科学研究科助教、German Institute of Human Nutrition博士研究員を経て、東京大学大学院農学生命科学研究科特任助教・同助教。2020年より京都女子大学家政学部准教授。博士(農学)。 「食物のおいしさ」について様々な角度から研究を行っています。 サナテックメールマガジンへのご意見・ご感想を〈e-magazine@mac.or.jp〉までお寄せください。 |
| Copyright (C) Food Analysis Technology Center SUNATEC. All Rights Reserved. |