カルシウムは骨や歯を形作る重要なミネラルであり、自然界にも様々な形で存在する。カルシウム量を求める方法は原子吸光光度法やプラズマ発光分光法といった機器分析が主流となりつつあるが、キレート滴定も多量のカルシウムを測定するうえで優良な方法として知られている。今回は食品添加物公定書に収載されている「カルシウム塩定量法」の方法を一例にカルシウム塩のキレート滴定について紹介する。
カルシウム塩のキレート滴定について
一般財団法人 食品分析開発センターSUNATEC
第一理化学検査室
1. はじめに
2. キレート滴定
キレート滴定はキレート試薬が金属イオンと錯体(キレート)を形成することを利用して金属イオン濃度を求める分析法である。キレート試薬は金属イオンと結合して環状構造の錯体を形成する有機化合物であり、錯体はキレート環と呼ばれ高い安定性を持つ。キレート試薬としてはエチレンジアミン四酢酸二水素二ナトリウム(EDTA)が最もよく使用されており、ほとんどの金属イオンと1:1のモル比で反応する。図にカルシウムイオンとEDTAのキレート形成反応を示す。
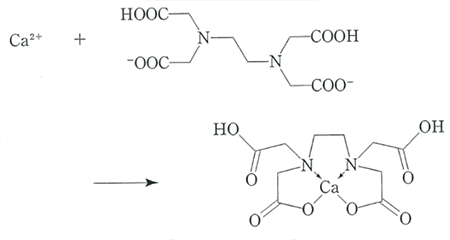
図 カルシウムイオンとEDTAのキレート形成反応(食品添加物公定書解説書)
EDTAを用いたキレート滴定ではEDTAと指示薬の2つのキレート試薬を使用する。指示薬は金属指示薬とも呼ばれ、遊離状態の色とキレートを形成した際の色が異なるという性質を持つ。EDTAのキレート錯体はほとんどが無色のためEDTAのキレート滴定では指示薬の色の変化を利用して終点を決定する。指示薬はキレート形成のしやすさ、いわゆるキレート生成定数がEDTAよりも十分に小さいものを選択し、常にEDTAとのキレート形成が優先されるようにする。しかし、指示薬の変色は一定のpH範囲のみで起こり、範囲外では遊離状態の色やキレート生成定数が変わるため、滴定の時は緩衝液などを添加してpHを保つ必要がある。また指示薬は終点で急激に変色するものばかりではないため、滴定中に指示薬と金属イオンがどのようにキレートの形成又は遊離を行うかを理解して終点を判断しなくてはならない。
3. カルシウム塩のキレート滴定
カルシウム塩のキレート滴定には直接滴定法と逆滴定法の2つの方法がある。直接滴定法は試料液をEDTA溶液で滴定する方法であり、塩化カルシウムなどのイオン化傾向の強いカルシウム塩に使用する。逆滴定法は一度過量のEDTA溶液を添加して試料液中のカルシウムイオンを全てキレート化した後、余剰のEDTA溶液を酢酸亜鉛溶液で滴定し、空試験で補正をかけることでカルシウム量を求める方法である。この方法はリン酸塩などのイオン化が段階的で直接滴定法での終点判別が難しいカルシウム塩や試料液をアルカリ性にすると析出が起こる場合に有用である。次にそれぞれの操作法を紹介する。
直接滴定法の操作法は次の通りである。まず試料を水に溶かして試料液を調製する。内10 mLを分取して水と水酸化カリウム溶液を添加して1分間放置した後、NN指示薬を加えて直ちにEDTA溶液で滴定を行う。滴定の終点は液の色が赤色から紫色を経て青色となる点である。NN指示薬はpH12~13においてカルシウムイオンのみとキレートを形成する指示薬で、遊離状態では青色、キレート状態では赤色を呈する。滴定前、試料液中のカルシウムイオンはNN指示薬とキレートを形成しているため液の色は赤色を呈する。滴定を開始すると滴加されたEDTAもカルシウムイオンとキレートを形成するがEDTAのキレート錯体の色は無色のため液の色は赤色のままである。滴定が進み余剰のカルシウムイオンが無くなると、キレート生成定数の差からEDTAがキレート状態のNN指示薬からカルシウムイオンを奪うため、NN指示薬が遊離して液の色に青色が混ざり赤紫色となる。さらに滴定を進めると液の色は青味を増し、紫色、青紫色を経て終点では指示薬が全て遊離した状態である青色を呈する。
逆滴定法の操作法は次の通りである。直接滴定法と同様に試料液を調製し、20 mLを分取して過量のEDTA溶液を加えてキレートを形成させる。その後、水とアンモニウム緩衝液(pH10.7)を加えて1分間放置し、指示薬としてエリオクロムブラックT・塩化ナトリウム試薬(EBT)を加え、直ちに酢酸亜鉛溶液で滴定する。滴定の終点は液の色が青色から青紫色となった点である。EBTはpH7~10でのキレート滴定に適した指示薬であり、遊離状態では青色を呈しキレート状態では赤色となる。滴定前、試料液のカルシウムイオンは全てEDTAに捕集されており、液には余剰のEDTAが存在する。またEBTは余剰の金属イオンがないため遊離状態であり液の色は青色である。滴定を開始すると酢酸亜鉛溶液から亜鉛イオンが供給され、キレート生成定数の大きいEDTAから優先的にキレートを形成する。滴定を進めて終点間際では余剰のEDTAが無くなり、EBTが亜鉛イオンとキレートを形成するため液の色は赤色が混ざり青紫色となる。すなわち液の青色がわずかに紫色に傾いたら滴定は終了である。
どちらの方法も指示薬の変色にやや時間がかかるため終点付近では滴定速度を落として過滴定とならないように注意が必要である。また、ガラスからの金属イオンのコンタミネーションを防ぐためプラスチック製の器具を出来る限り使用するのが望ましい。
4. 最後に
EDTAを用いたキレート滴定では、指示薬の作用するpH領域によっては目的外の金属イオンをはかりこむ場合があるため、多くの場合マスキング剤を添加する。マスキング剤は共存イオンの滴定への影響を無くす目的で添加されるものでトリエタノールアミンや塩酸ヒドロキシルアミン、シアン化カリウムなどがよく使用される。カルシウム塩の直接滴定法では水酸化カリウム溶液がpH調整とマスキング剤を兼ねており、pHを強アルカリ性にすることでほとんどの金属イオンを水酸化物として沈殿させる事ができる。マグネシウムイオンはカルシウム量を求める際に影響を与えやすいイオンだが、直接滴定法では沈殿として除く事が出来る。一方、逆滴定法では滴定するpHがそれほど高くないためマグネシウムイオンの分離定量は不可能である。必要であればシュウ酸アンモニウムでカルシウムを沈殿させて共存イオン量を求めるといった追試験を行うとよい。
参考文献
- 1)
- “第9版食品添加物公定書解説書” 廣川書店(2019)
- 2)
- 公益社団法人 日本薬学会編集“衛生試験法・注解2015” 金原出版(2015)
- 3)
- 公益社団法人 日本薬学会編集“衛生試験法・注解2015” 金原出版(2015)
- 4)
- 上野景平,“解説 EDTA の使い方” JAPAN ANALYST Vol. 8 207-214(1959)
- 5)
- 同仁化学研究所,“比色試薬/金属指示薬 NN”
- 6)
- 同仁化学研究所,“比色試薬/金属指示薬 BT”
